
Nosotros pensamos que diferentes científicos trabajen juntos ayuda al desarrollo de la ciencia por que un solo científico no hace lo mismo que 2. Encima que J.J. Thomson fuera profesor de Rutherford es interesante para los dos: para Rutherford aprender de un científico de la categoría de Thomson resultaría muy interesante, pero a su vez, para Thomson resultaría interesante y beneficioso para el ser profesor de un científico listo y con ganas de trabajar que le ayudaría en sus experimento; pero es que a su vez Rutherford fue profesor de Hans Geiger, un científico alemán con una capacidad de trabajo inagotable. Rutherford, con Geiger hicieron numerosas cosas. Entre ellas destacan un aparato eléctrico que registraba y contaba las partículas alfas de una en una; también averiguaron muchas otras cosas. Este hecho demuestra que los investigadores científicos forman a los estudiantes hace que se transmitan sabiduría entre ellos, lo que hace que haya un, mayor número de inventos y de descubrimientos.
En las facultades de ciencia española
ACTIVIDAD 2:
“toda ciencia, o es Física, o es coleccionismo de sello”
En esa frase Rutherford se refiere a que la física es lo más importante de la ciencia, “despreciando” así otras partes de la ciencia como la química, aunque luego recibe el premio Nobel de química en vez de física. Su segunda frase: "He cambiado muchas veces en mi vida, pero nunca de manera tan brusca como en esta metamorfosis de físico a químico", es un poco la respuesta a ese premio Nobel, ya que el reconoció que a el le importaba la física y que para el la química y otras partes de la ciencia eran como “coleccionismo de sellos”. El se consideraba a si mismo físico por lo que se sorprendió al recibir el premio Nobel de química en vez de física.
Se denomina química, a la ciencia que estudia la composición, estructura y propiedades de la materia, como los cambios que esta experimenta durante reacciones químicas.
La física es una ciencia natural que estudia las propiedades del espacio, el tiempo, la materia, la energía y sus interacciones. La física no es sólo una ciencia teórica, es también una ciencia experimental. Como toda ciencia, busca que sus conclusiones puedan ser verificables mediante experimentos y que la teoría pueda realizar predicciones de experimentos futuros.
Aunque la física incluye dentro de su campo de estudio a la química y además de explica sus fenómenos, la química no es lo mismo que la física, ya que son ciencias que estudian dos cosas muy diferentes; ya que la química estudia la materia y la física estudia diferentes propiedades (espacio, tiempo, energía…)
ACTIVIDAD 3:
 -Tesla dominó disciplinas como la física, las matemáticas y la electricidad y es considerado el padre de la corriente alterna y fundador de la industria eléctrica. Entre sus inventos más importantes están la radio, las bobinas para el generador eléctrico de corriente alterna, el motor de inducción (eléctrico), las bujías, la bobina, el alternador, el control remoto...
-Tesla dominó disciplinas como la física, las matemáticas y la electricidad y es considerado el padre de la corriente alterna y fundador de la industria eléctrica. Entre sus inventos más importantes están la radio, las bobinas para el generador eléctrico de corriente alterna, el motor de inducción (eléctrico), las bujías, la bobina, el alternador, el control remoto...-Nikola Tesla nació en el pueblo de Smiljan en la Frontera Militar, se educó en Graz y posteriormente en Praga donde estudió ingeniería eléctrica. En 1881 viaja a Budapest para trabajar en una compañía de telégrafos norteamericana. Al año siguiente se traslada a París para trabajar en una de las compañías de Thomas Alva Edison, donde realizó su mayor aportación: la teoría de la corriente alterna en electricidad, lo cual le permitió idear el primer motor de inducción en 1882. En 1884 se traslada a Nueva York, creando su propia compañía en 1886 tras romper con Edison.
En las cataratas del Niágara se construyó la primera central hidroeléctrica gracias a los desarrollos de Tesla en 1893, consiguiendo en 1896 transmitir electricidad a la ciudad de Búfalo. Con el apoyo financiero de George Westinghouse, la corriente alterna sustituyó a la continua. Tesla fue considerado desde entonces el fundador de la industria eléctrica.
En su honor se llamó Tesla a la unidad de campo magnético en el Sistema Internacional de Unidades.
Este es un video en el que se ve uno de sus inventos, la bobina.
En 1893 consiguió transmitir energía electromagnética sin cables, construyendo el primer radiotransmisor (adelantándose Marconi). Tesla presenta la patente correspondiente en 1897, dos años después de que Marconi lograra su primera transmisión de radio. No obstante, Marconi registra su patente recién el 10 de noviembre de 1900 y es rechazada por ser considerada una copia de la patente de Tesla. Se inicia un litigio entre la compañía de Marconi y Tesla.
 a) Existen dos clases de minerales luminiscentes, es decir, que emiten luz según la temperatura a la que son sometidos: los fluorescentes y los fosfoescentes.
a) Existen dos clases de minerales luminiscentes, es decir, que emiten luz según la temperatura a la que son sometidos: los fluorescentes y los fosfoescentes. ero su emisión verdosa persiste aun cuando se las dejaba de radiar o iluminar. Es necesario añadir que la fosforescencia tenía que ser estimulada por luz normal.
ero su emisión verdosa persiste aun cuando se las dejaba de radiar o iluminar. Es necesario añadir que la fosforescencia tenía que ser estimulada por luz normal. 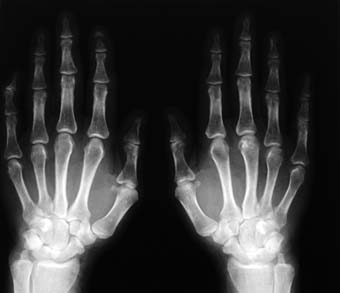 os opacos como la piel y los músculos. Por eso se utilizan médicamente sobre los seres humanos, porque como no atraviesan los huesos, son perfectos para detectar fracturas, roturas o cualquier daño causado en éstos. Estos rayos los descubrió Nikola Telsa, al notar en un experimento que un objeto se iluminaba cuando encendía su equipo de rayos catódicos. Entonces supuso que habia unos rayos que penetraban en este objeto pero que eran invisibles, y los estudió a fondo. Les puso el nombre de rayos X porque no sabía de donde venían ni de que eran, no sabía casi nada acerca de ellos.
os opacos como la piel y los músculos. Por eso se utilizan médicamente sobre los seres humanos, porque como no atraviesan los huesos, son perfectos para detectar fracturas, roturas o cualquier daño causado en éstos. Estos rayos los descubrió Nikola Telsa, al notar en un experimento que un objeto se iluminaba cuando encendía su equipo de rayos catódicos. Entonces supuso que habia unos rayos que penetraban en este objeto pero que eran invisibles, y los estudió a fondo. Les puso el nombre de rayos X porque no sabía de donde venían ni de que eran, no sabía casi nada acerca de ellos. e) Rutherford descubrió que los rayos alfa y beta (las dos primeras letras del alfabeto griego) son dos clases de rayos muy distintas que emiten los elementos radiactivos. Además dedujo que los rayos beta no eran mas que electrones. Los rayos alfa se obtenían se obtenían situando una fuente radiactiva intensa en un contenedor de plomo cerrado pero con una pequeña abertura. Rutherford trabajó con estos rayos y con el famoso experimento del pan de oro y los electrones descubrió el núcleo atómico.
e) Rutherford descubrió que los rayos alfa y beta (las dos primeras letras del alfabeto griego) son dos clases de rayos muy distintas que emiten los elementos radiactivos. Además dedujo que los rayos beta no eran mas que electrones. Los rayos alfa se obtenían se obtenían situando una fuente radiactiva intensa en un contenedor de plomo cerrado pero con una pequeña abertura. Rutherford trabajó con estos rayos y con el famoso experimento del pan de oro y los electrones descubrió el núcleo atómico.
g) El contador Geiger es un instrumento que sirve para medir la radiactividad de un objeto o lugar. Está formado por un tubo metálico con hilio también metálico muy fino en su interior, a lo largo de su centro. Dentro del tubo, se encuentra el gas argón a una presión de 260mmHg mezclado con vapor de etano o neón, y con vapor de bromo.
Para empezar habría que decir que en estos tiempos se pensaba que los electrones estaban incluídos o impregnados en lo que es el átomo. El experimento no comenzó directamente de las manos de Rutherford sino que éste les dijo a sus alumnos más destacados, Geiger y Mardsen que realizaran el experimento. Lo que éstos hicieron fue enviar partículas alfa, que se obtienen como ya hemos dicho anteriormente, a un pan de mica. Las partículas atravesaban las finas láminas de mica y ninguna se desviaba. Pero Geiger le pidió a Rutherford intentarlo con otros materiales y Rutherford le dijo, para su asombro, que probase con pan de oro, ya que se podían hacer láminas finísimas con este material. Al hacer pasar el haz de partículas sobre el oro el resultado era casi el mismo salvo porque casi una de 8000 particulas era desviada o rebotaba por completo. Rutherford se interesó por este hecho he hizo que se calculase la probabilidad de que esto sucediera. Entonces dedujo que las partículas chocaban contra algo de su misma carga para poder rebotar. Había descubierto el núcleo atómico, lo que a la vez falsó la hipótesis de Thomson, que decía que los electrones estaban inmersos en el átomo. Esto no podía ser así ya que claramente la mayoría de las partículas pasaban a través de la lámina de oro, es decir, pasaban a traves de la zona en la que no estaban los núcleos, la zona en la que se encuentran los electrones que al ser tan pequeños podían ser atravesados sin dificultad. Pero cuando una partícula rebotaba lo que ocurría era que daba justo en el núcleo, que al ser positivo hacía que rebotase.
Más tarde se probó el mismo experimento pero con platino en vez de oro y fue mucho más notable el efecto ya que el platino tiene mayor tendencia a perder electrones (mayor electronegatividad) y además tiene menos electrones, lo que hacía que el espacio del núcleo fuese mayor y más partículas rebotaran.
La frase: " es como si se disparara un obús naval de buen calibre sobre una hoja de papel y rebotara" quiere decir que es impensable que una partícula alfa muy cargada de energía rebotase en una finísima lámina de oro o platino ya que como es lógico esta rompería y atravesaría la lámina, así como el obús naval atravesaría a su vez la hoja de papel. Esto se debe claramente a las cargas: positivo con positivo se repelen y por eso rebota con tal contundencia.
Aquí hay dos vídeos que explican bastante bien cómo fue realizado el experimento de Rutherford. Sobre todo el segundo está muy bien explicado ya que además da a entender que las partículas alfa estan cargadas positivamente y se ve a cámara lenta.
ACTIVIDAD 6
Para explicar estos hechos, Rutherford propuso el modelo atómico nuclear que sitúa la mayor parte de la masa de átomo concentrada en una zona muy pequeña del mismo (contra la que chocaban las partículas desviadas). El modelo supone que el resto del átomo esta prácticamente vacío. Los átomos contienen el mismo número de electrones en la corteza que de protones en el núcleo; en consecuencia, son neutros. El modelo atómico nuclear distingue dos partes en el átomo: el núcleo y la corteza.
- El núcleo es la parte central del átomo y contiene partículas con carga positiva, los
protones, y partículas que no poseen carga eléctrica, es decir son neutras, los
neutrones. La masa de un protón es aproximadamente igual a la de un
neutrón. Todos los átomos de un elemento químico tienen en el núcleo el mismo
número de protones. Este número, que caracteriza a cada elemento y lo distingue de
los demás, es el número atómico y se representa con la letra Z.
- La corteza es la parte exterior del átomo. En ella se encuentran los electrones,
con carga negativa. Éstos, ordenados en distintos niveles, giran alrededor del
núcleo. La masa de un electrón es unas 2000 veces menor que la de un protón.
A Rutherford se le considera el padre de la interacción nuclear ya que gracias a sus investigaciones acerca de las interacciones. Según la interacción nuclear fuerte la fuerza obliga a los núcleos a permanecer unidos.
A continuación explicaremos las 4 interacciones fundamentales de la naturalezan que son: interacción nuclear fuerte, interacción nuclear débil, interacción electromagnética e interacción gravitatoria.
Interacción gravitatoria. Es la más conocida de las interacciones debido a que a grandes distancias, como las observadas habitualmente, tiene mayores impactos que las demás. Junto al electromagnetismo, son las interacciones que actúan a grandes distancias y contraria a esta, tiene solo carácter de atracción. En comparación con el resto de fuerzas es la más débil.
Ésta hace que la energía interaccione entre sí y con la masa al ser ésta representación más intuitiva de energía, actúa sobre ella. La teoría de la relatividad general estudia esta interacción y la describe como una Curvatura del espacio-tiempo, en otras palabras a la deformación que sufre el espacio-tiempo por la presencia de grandes masas.
Según hipótesis del modelo estándar, la interacción gravitatoria, gravitación o fuerza de la gravedad, es transmitida por el gravitón. Cabe indicar que la teoría de la gravitación, en su formulación actual, no es una interacción que sea muy consistente con la descripción usual de la física de partículas. Sin embargo, debido a que la gravitación aparece sólo en distancias muy por encima del radio atómico esto permite en la práctica usar ambas teorías simultáneamente sin encontrar demasiado conflicto.
Interacción electromagnética. El electromagnetismo es la interacción que actúa entre partículas con carga eléctrica. Este fenómeno incluye a la fuerza electrostática, que actúa entre cargas en reposo, y el efecto combinado de las fuerzas eléctrica y magnética que actúan entre cargas que se mueven una respecto a la otra.
El electromagnetismo también tiene un alcance infinito y como es mucho más fuerte que la gravedad describe casi todos los fenómenos de nuestra experiencia cotidiana. Estos van desde el rayo láser y la radio, a la estructura atómica y a fenómenos tales como la fricción y el arco iris.
Los fenómenos eléctricos y magnéticos han sido observados desde la antigüedad, pero fue a partir de 1800 que los científicos descubrieron que la electricidad y el magnetismo son dos aspectos fundamentales de la misma interacción. En 1864, las ecuaciones de Maxwell habían unificado rigurosamente ambos fenómenos. En 1905, la teoría de Einstein de la relatividad especial resolvió la cuestión de la constancia de la velocidad de la luz. También Einstein explicó el efecto fotoeléctrico al teorizar que la luz se transmitía también en forma de cuantos, que ahora llamamos fotones. A partir de 1927, Paul Dirac unifica la mecánica cuántica con la teoría relativista del electromagnetismo, la teoría de la electrodinámica cuántica, que se completó en la década de 1940.
Interacción nuclear fuerte. La interacción fuerte, también conocida como interacción nuclear fuerte, es la interacción que permite a unirse a los quarks para formar hadrones. La interacción electromagnética se da entre partículas cargadas eléctricamente, aquí las partículas también tienen carga, la carga de color. Su accionar a pesar de ser el más fuerte sólo se lo aprecia a muy cortas distancias tales como el radio atómico. Según el modelo estándar, la partícula mediadora de esta fuerza es el gluón. La teoría que describe a esta interacción es la cromodinámica cuántica (QCD) y fue propuesta por David Politzer, Frank Wilczek y David Gross en la década de 1980.
Como resultado colateral de la interacción entre quarks, existe una manifestación de la fuerza nuclear fuerte que explica que dentro del núcleo atómico a los protones y neutrones. Debido a la carga positiva de los protones, para que éstos se encuentren estables en el núcleo debía existir una fuerza más fuerte que la electromagnética para retenerlos. Ahora sabemos que la verdadera causa de que los protones y neutrones no se desestabilicen es la llamada interacción fuerte residual. Esta interacción entre nucleones (protones y neutrones) se produce a través de parejas de quark-antiquark en forma de piones.
Interacción nuclear débil. La interacción débil, también conocida como interacción nuclear débil, se acopla a un tipo de carga llamada sabor, que la poseen los quarks y los leptones. Esta interacción es la causante de los cambios de sabor en estas partículas, en otras palabras es la responsable que de quarks y leptones decaigan en partículas más livianas, además es la que produce desintegraciones beta. La teoría de Glashow-Weinberg-Salam estudia la interacción débil y la electrodinámica cuántica de manera unificada en lo que se llama Modelo electro débil.
Según el modelo estándar, la interacción débil es mediada por los bosones W y Z que son partículas muy masivas. Su intensidad es menor que la intensidad de la electromagnética y su alcance es menor que el de la interacción fuerte. Al igual que la interacción fuerte y la gravitatoria es esta una interacción únicamente atractiva.
Los físicos están tratando de derivar una teoría unificada que describa a todas las fuerzas de la naturaleza en una sola ley fundamental. Hasta ahora han logrado producir una descripción unificada de la fuerza débil y electromagnética, pero aún no han alcanzado un conocimiento más profundo sobre las fuerzas fuerte y gravitacional.
La física cuántica describe el efecto mutuo de las fuerzas en las partículas por el "intercambio" de otras partículas. Por ejemplo, las partículas eléctricamente cargadas se atraen o repelan al emitir y absorber fotones, los cuales están a cargo de la interacción electromagnética.

 Hemos optado por una estrella dorada porque es el oro precisamente lo que usó Ernest Rutherford para realizar el experimento.
Hemos optado por una estrella dorada porque es el oro precisamente lo que usó Ernest Rutherford para realizar el experimento. 



























